Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira 2023
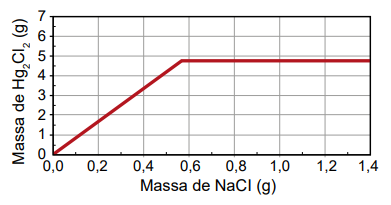
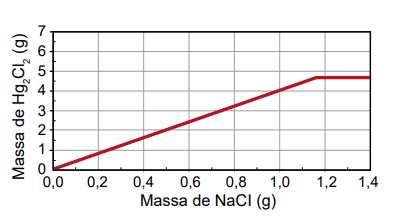
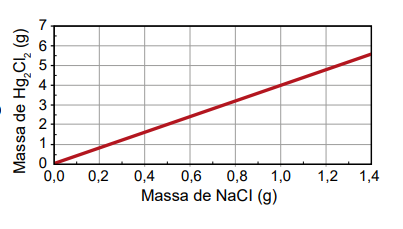
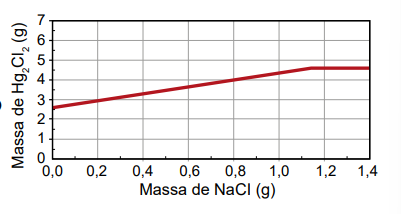
Um assistente de laboratório precisou descartar sete frascos contendo solução de nitrato de mercúrio(I) que não foram utilizados em uma aula prática. Cada frasco continha 5,25 g de Hg₂ (NO₃)2 dissolvidos em água. Temendo a toxidez do mercúrio e sabendo que o Hg₂Cl₂ tem solubilidade muito baixa, o assistente optou por retirar o mercúrio da solução por precipitação com cloreto de sódio (NaCl), conforme a equação química:
Hg₂(NO₃)2 (aq) + 2 NaCl (aq) → Hg₂Cl₂ (s) + 2 NaNO₃ (aq)
Na dúvida sobre a massa de NaCl a ser utilizada, o assistente aumentou gradativamente a quantidade adicionada em cada frasco, como apresentado no quadro.
Frasco
I
II
III
IV
V
VI
VII
Massa de NaCl em grama (g)
0,2
0,4
0,6
0,8
1,0
1,2
1,4
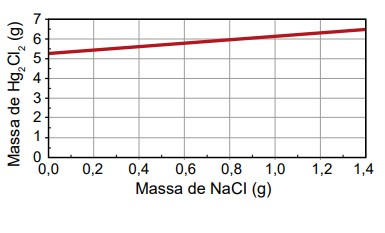
O produto obtido em cada experimento foi filtrado, secado e teve sua massa aferida. O assistente organizou os resultados na forma de um gráfico que correlaciona a massa de NaCl adicionada com a massa de Hg₂Cl₂ obtida em cada frasco. A massa molar do Hg₂ (NO₃)2 é 525 g mol–1, a do NaCl é 58 g mol–1 e a do Hg₂Cl₂ é 472 g mol–1.
Qual foi o gráfico obtido pelo assistente de laboratório?
E mais: nota TRI a todo o momento.





