ETEC 2011/2
Por volta de 1834, o norte-americano Charles Goodyear teve a ideia de misturar um pó seco à borracha, para absorver o excesso de umidade que a tornava muito pegajosa quando fazia calor.
Em 1839, enquanto fazia experiências com enxofre em pó como agente secante, acidentalmente deixou cair, sobre um fogão quente, um pouco de borracha misturada ao enxofre.
A massa carbonizada e viscosa que se formou chamou sua atenção, o que o levou a descobrir um processo que produziria resultados uniformes: uma borracha permanentemente rija, elástica e estável, no inverno ou no verão.
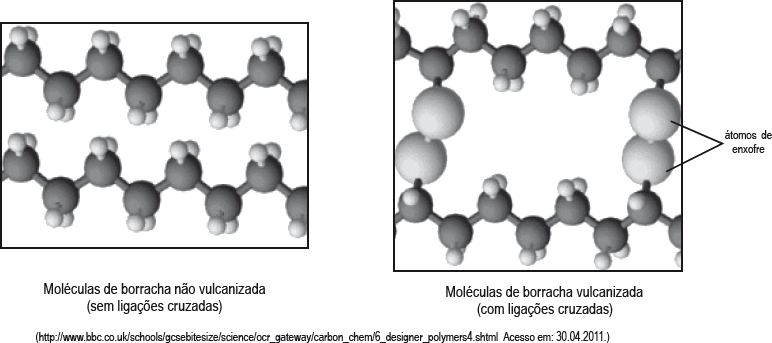
Goodyear, por não ser químico e desconhecer a estrutura da borracha natural, não compreendeu que, com o enxofre, tinha conseguido as ligações cruzadas fundamentais entre as moléculas de borracha, o que permite que essas moléculas permaneçam flexíveis, mas impede que escorreguem umas pelas outras com o calor.
(LE COUTEUR, Penny e BURRESON, Jay. Os botões de Napoleão: as 17 moléculas que mudaram a História. Rio de Janeiro: Jorge Zahar, 2006. Adaptado)
O processo descrito anteriormente foi denominado vulcanização da borracha em referência a Vulcano, o deus romano do fogo.
Observe, nos esquemas a seguir, como os átomos de enxofre “prendem” as cadeias umas às outras.
A combustão da borracha vulcanizada potencializa a formação da chuva ácida, pois
o enxofre liberado não reage com a água da chuva.
a reação da borracha com a água da chuva aumenta a acidez da água.
a combustão é incompleta, formando a fuligem (carvão em pó), que reage com a água da chuva.
a borracha, quando queimada, produz compostos de caráter básico, neutralizando a acidez da chuva.
o enxofre, quando queimado, produz compostos que reagem com a água da chuva tornando-a mais ácida.
E mais: nota TRI a todo o momento.





