Por terem camada de valência completa, alta energia de ionização e afinidade eletrônica praticamente nula, considerou-se por muito tempo que os gases nobres não formariam compostos químicos. Porém, em 1962, foi realizada com sucesso a reação entre o xenônio (camada de valência 5s25p6) e o hexafluoreto de platina e, desde então, mais compostos novos de gases nobres vêm sendo sintetizados. Tais compostos demonstram que não se pode aceitar acriticamente a regra do octeto, na qual se considera que, numa ligação química, os átomos tendem a adquirir estabilidade assumindo a configuração eletrônica de gás nobre. Dentre os compostos conhecidos, um dos mais estáveis é o difluoreto de xenônio, no qual dois átomos do halogênio flúor (camada de valência 2s22p5) se ligam covalentemente ao átomo de gás nobre para ficarem com oito elétrons de valência.
clear
ENEM 2019
Ao se escrever a fórmula de Lewis do composto de xenônio citado, quantos elétrons na camada de valência haverá no átomo do gás nobre?
a
6
b
8
c
10
d
12
e
14
Ver resposta
Ver resposta
Resposta
C
Tempo médio
1 min
Resolução
Assine a AIO para ter acesso a esta e muitas outras resoluções
Mais de 300.000 questões com resoluções e dados exclusivos disponíveis para alunos AIO.
E mais: nota TRI a todo o momento.
E mais: nota TRI a todo o momento.
Saiba mais
Esta resolução não é pública. Assine a aio para ter acesso a essa resolução e muito mais:
Tenha acesso a simulados reduzidos, mais de 200.000 questões, orientação personalizada,
video aulas, correção de redações e uma equipe sempre disposta a te ajudar.
Tudo isso com acompanhamento TRI em tempo real.
Dicas
expand_more
expand_less
Dicas sobre como resolver essa questão
Erros Comuns
expand_more
expand_less
Alguns erros comuns que estudantes podem cometer ao resolver esta questão
Conceitos chave
Conceitos chave sobre essa questão, que pode te ajudar a resolver questões similares
Estratégia de resolução
Uma estratégia sobre a forma apropriada de se chegar a resposta correta
20%
Taxa de acerto
0.5
Média de pontos TRI
Habilidade
Utilizar códigos e nomenclatura da química para caracterizar materiais, substâncias ou transformações químicas.
Porcentagem de alternativa escolhida por nota TRI
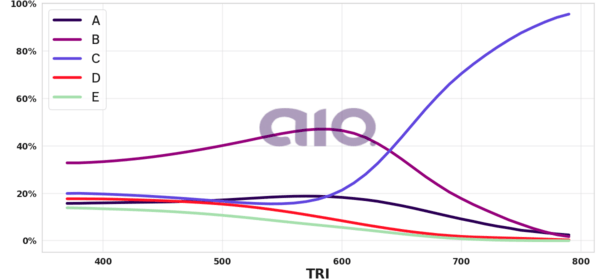
Porcentagem de alternativa escolhida por nota TRI

Transforme seus estudos com a AIO!
Estudantes como você estão acelerando suas aprovações usando nossa plataforma de
AI + aprendizado ativo.
+25 pts
Aumento médio TRI
4x
Simulados mais rápidos
+50 mil
Estudantes

Débora Adelina
O que mais gostei foi a forma como a plataforma seleciona matérias em que tenho mais dificuldade, ajudando a focar no que realmente preciso de atenção. Ainda não consegui minha aprovação, mas contarei com a AIO por mais um ano pois a plataforma me aproximou desse objetivo tornando meus estudos mais direcionados!

Mariana Scheffel
AIO foi fundamental para a evolução do meu número de acertos e notas, tanto no ENEM quanto em outros vestibulares, fornecendo os recursos e as ferramentas necessárias para estudar de forma eficaz e melhorar minhas notas.

Joice Neves
Faltavam 3 meses para o ENEM, eu estava desesperada e mentalmente fragilizada por não ver os resultados do meu esforço. Então, eu encontrei a AIO e, em 3 meses, eu consegui aumentar a minha nota média em 50 pontos. Meses depois, fui aprovada no curso que eu tanto desejei. Esse sonho se tornou real graças à AIO.


