Instituto Tecnológico de Aeronáutica 2022
Constantes
Constante de Avogadro (NA) \(\qquad\) = \(\qquad\) 6,02 × 1023 mol−1
Constante de Faraday (F) \(\qquad\) = \(\qquad\) 9,65 × 104 C mol−1 = 9,65 × 104 A s mol−1 = 9,65 × 104 J V−1 mol−1
Carga elementar \(\qquad\) \(\qquad\) = \(\qquad\) 1,60 × 10−19 C
Constante dos gases (R) \(\qquad\) = \(\qquad\) 8,21 × 10−2 atm L K−1 mol−1 = 8,31 J K−1 mol−1 = 1,98 cal K−1 mol−1
Constante de Planck (h) \(\qquad\) = \(\qquad\) 6,63 × 10−34 J s
Velocidade da luz no vácuo \(\qquad\) = \(\qquad\) 3,0 × 108 m s−1
Número de Euler (e) \(\qquad\) = \(\qquad\) 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N m−2 = 1,01325 bar
Energia: 1 J = 1 N m = 1 kg m² s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol L−1
ln X = 2,3 log X
Massas Molares
Elemento
Químico
Número
Atômico
Massa Molar
(g mol−1)
Elemento
Químico
Número
Atômico
Massa Molar
(g mol−1)
H
1
1,01
P
15
30,97
Li
3
6,94
S
16
32,06
B
5
10,81
Cl
17
35,45
C
6
12,01
K
19
39,1
N
7
14,01
Ca
20
40,08
O
8
16
Ga
31
69,72
F
9
19
Se
34
78,96
Na
11
22,99
Sr
38
87,62
Al
13
26,98
Os seguintes diagramas representam diferentes estados de equilíbrio de uma reação exotérmica do tipo \(A_2\) \((g)\) \(+\ B_2\left(g\right)\ \) \(\rightleftharpoons\) \(2AB(g).\)
(I) 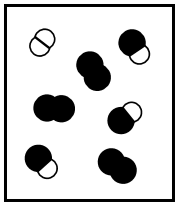 (II)
(II) 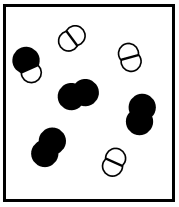 (III)
(III) 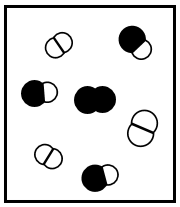 (IV)
(IV) 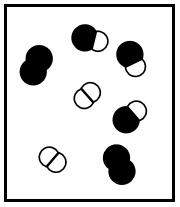
Assinale a opção que contém a afirmação CORRETA.
Se a constante de equilíbrio da reação, \(K\)c, em um determinada temperatura, é igual a 3, apenas o diagrama (I) representa o sistema no equilíbrio.
Os diagramas (II) e (IV) podem representar a situação da reação em equilíbrio em duas temperaturas diferentes, com TII ˃ TIV.
Se todos os diagramas representam a reação em equilíbrio, o diagrama (III) representa a reação com a menor constante de equilíbrio.
Se a pressão for reduzida à metade pela duplicação do volume, em temperatura constante, os diagramas (II) e (III) representam a reação em equilíbrio para o estado inicial e final, respetivamente, desse processo, com VII = 2VIII.
Se cada símbolo que representa uma molécula nos diagramas equivale a 0,20 mol e se o volume do recipiente é 1,0 L, a constante de equilíbrio da reação representada pelo diagrama (I) é 0,5.
E mais: nota TRI a todo o momento.





