FMABC 2017
Os indicadores ácido base são substâncias cuja cor se altera em uma faixa específica de pH. Cada indicador – atua como um ácido fraco, havendo um equilíbrio entre a forma protonada (HInd) e a sua base conjugada (Ind ). Cada uma dessas espécies apresenta cores diferentes, dessa forma a tonalidade da solução depende da concentração das duas espécies. A equação a seguir resume as características do equilíbrio químico em solução aquosa desses corantes.
HInd(aq) + H O(l)↔ H3 O+ (aq) + Ind (aq)
COR A COR B
A tabela a seguir apresenta a faixa de viragem (mudança de cor) de alguns indicadores ácido base.
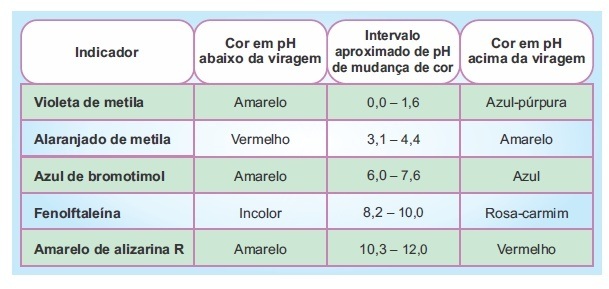
A respeito desses indicadores foram feitas algumas observações:
I. A forma protonada (HInd) da fenolftaleína é incolor.
II. A constante de ionização (Ka) do violeta de metila é menor do que a constante de ionização do azul de bromotimol.
III. Para confirmar que um suco de limão apresenta pH entre 2 e 3, bastaria testá-lo com violeta de metila.
IV. O alaranjado de metila é um ácido mais forte do que a fenolftaleína.
Estão corretas apenas as afirmações:
I e II.
I e III.
II e IV.
I e IV.
E mais: nota TRI a todo o momento.





