UNICENTRO 2017
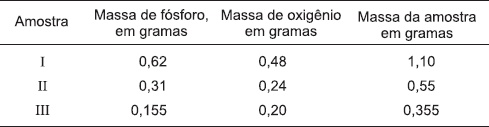
Os experimentos realizados por John Dalton, no século XVIII, levaram-no a conclusões importantes para o nascimento da Química, como Ciência Experimental. A lei das proporções múltiplas e a Teoria Atômica da matéria foram as maiores contribuições de John Dalton para o desenvolvimento científico. Os resultados das informações da tabela se referem à análise de amostras de óxidos de fósforo, a partir de alguns experimentos.
Considerando-se esses dados e com base nos conhecimentos da lei das proporções múltiplas de John Dalton, é correto concluir:
A amostra I é de P2O5.
As amostras II e III são de P2O3.
A amostra II possui 56% de oxigênio.
A amostra I tem menor percentual de fósforo em relação à amostra III.
A proporção entre as massas de oxigênio que se combinam com a massa fixa de fósforo, nos óxidos de fósforo, é de 3:5.
E mais: nota TRI a todo o momento.





