EBMSP 2015/2
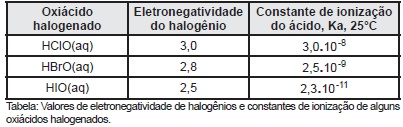
Os ácidos são substâncias químicas associadas a muitos processos químicos industriais, biológicos e ambientais. A ionização de ácidos fracos em água, a exemplo dos oxiácidos halogenados relacionados na tabela, é parcial e, consequentemente, na solução aquosa coexistem, em equilíbrio, moléculas do ácido e os íons formados na ionização, o que permite a determinação da constante de equilíbrio para a ionização. Nos oxiácidos que têm a estrutura H — O — X, em que X representa um halogênio, o valor da constante de equilíbrio do ácido está relacionada com a eletronegatividade do halogênio, de acordo com os dados da tabela.
Considerando-se essas informações e os conhecimentos sobre equilíbrio químico, é correto afirmar:
A força do oxiácido halogenado aumenta com a redução da eletronegativdade do halogênio presente na estrutura.
A base conjugada do ácido hipobromoso, BrO‒(aq), é mais forte do que a base conjugada do ácido hipoiodoso, IO‒(aq).
O valor da constante de ionização do ácido hipoiodoso, HIO(aq), é obtida pela relação \(Ka=\frac{\left[HIO\left(aq\right)\right]}{\left[H_3O^+\left(aq\right)\right]\left[IO^-\left(aq\right)\right]}\)
A liberação de íons H+(aq) na ionização do ácido hipocloroso, HClO(aq), é mais fácil do que na ionização do ácido hipobromoso, HBrO(aq).
O poder de atração do halogênio sobre o hidrogênio está relacionado ao número de elétrons não ligantes sobre o átomo de halogênio, na estrutura do ácido.
E mais: nota TRI a todo o momento.





