clear
PUC-RJ 2018
O hidróxido de cálcio, Ca(OH)₂, pode ser neutralizado com H₂SO₄, de acordo com a equação química balanceada representada a seguir:
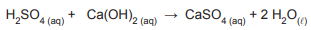
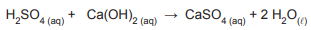
A respeito das espécies químicas que participam dessa reação de neutralização, verifica-se que o
a
H₂SO₄ atua como base de Arrhenius.
b
Ca(OH)₂ atua como ácido de Arrhenius.
c
CaSO₄ é um sal de caráter neutro.
d
CaSO₄ é um óxido ácido.
e
CaSO₄ é um óxido básico.
Ver resposta
Ver resposta
Resposta
C
Resolução
Assine a AIO para ter acesso a esta e muitas outras resoluções
Mais de 300.000 questões com resoluções e dados exclusivos disponíveis para alunos AIO.
E mais: nota TRI a todo o momento.
E mais: nota TRI a todo o momento.
Saiba mais
Esta resolução não é pública. Assine a aio para ter acesso a essa resolução e muito mais:
Tenha acesso a simulados reduzidos, mais de 200.000 questões, orientação personalizada,
video aulas, correção de redações e uma equipe sempre disposta a te ajudar.
Tudo isso com acompanhamento TRI em tempo real.
Dicas
expand_more
expand_less
Dicas sobre como resolver essa questão
Erros Comuns
expand_more
expand_less
Alguns erros comuns que estudantes podem cometer ao resolver esta questão
Conceitos chave
Conceitos chave sobre essa questão, que pode te ajudar a resolver questões similares
Estratégia de resolução
Uma estratégia sobre a forma apropriada de se chegar a resposta correta
Transforme seus estudos com a AIO!
Estudantes como você estão acelerando suas aprovações usando nossa plataforma de
AI + aprendizado ativo.
+25 pts
Aumento médio TRI
4x
Simulados mais rápidos
+50 mil
Estudantes

Mariana Scheffel
AIO foi fundamental para a evolução do meu número de acertos e notas, tanto no ENEM quanto em outros vestibulares, fornecendo os recursos e as ferramentas necessárias para estudar de forma eficaz e melhorar minhas notas.

Jairo Thiago
Conheci a plataforma através de uma reportagem e, como gosto de IA, resolvi investir. A quantidade de questões e suas análises foram tão boas que meu número de acertos foi o suficiente para entrar em Medicina na Federal do meu estado, só tenho que agradecer à equipe do AIO pela minha tão sonhada aprovação!

Jonas de Souza
As correções de redações e as aulas são bem organizadas e é claro os professores são os melhores com a melhor metodologia de ensino, sem dúvidas contribuiu muito para o aumento de 120 pontos na minha média final!


