UEFS Caderno 2 2016/1
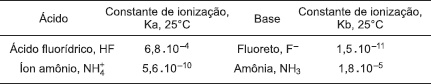
O conceito de ácido e de base, de Brönsted-Lowry, tem como fundamento a transferência de um próton, H+, de uma substância para outra, nas reações entre ácidos e bases. Segundo esses químicos, os ácidos são substâncias, representadas por moléculas ou íons, que podem doar prótons, e as bases são receptoras de prótons. Portanto, um ácido terá sempre uma base conjugada e uma base seu ácido conjugado, a exemplo do ácido fluorídrico e do ânion fluoreto, e do ânion amônio e da amônia, citados na tabela. A constante de ionização do ácido ou da base indica a tendência de ionização da espécie química em água.
Uma análise das informações e dos dados apresentados na tabela de pares conjugados ácido-base permite corretamente afirmar:
A capacidade para doar o próton é maior no íon amônio do que no ácido fluorídrico.
A base conjugada do íon amônio é mais fraca do que a base conjugada do ácido fluorídrico.
A molécula de água, ao formar o íon hidrônio, H3O+(aq), atua como um ácido de Brönsted-Lowry.
O sal, fluoreto de amônio, NH4F(s), dissolvido em água, dá origem a uma solução básica.
O produto entre a constante de ionização do ácido fluorídrico e a constante de ionização do íon fluoreto é, aproximadamente, igual ao produto iônico da água, Kw.
E mais: nota TRI a todo o momento.





