clear
ENEM 2016
O carvão ativado é um material que possui elevado teor de carbono, sendo muito utilizado para a remoção de compostos orgânicos voláteis do meio, como o benzeno. Para a remoção desses compostos, utiliza-se a adsorção. Esse fenômeno ocorre por meio de interações do tipo intermoleculares entre a superfície do carvão (adsorvente) e o benzeno (adsorvato, substância adsorvida).
No caso apresentado, entre o adsorvente e a substância adsorvida ocorre a formação de:
a
Ligações dissulfeto.
b
Ligações covalentes.
c
Ligações de hidrogênio.
d
Interações dipolo induzido – dipolo induzido.
e
Interações dipolo permanente – dipolo permanente.
Ver resposta
Ver resposta
Resposta
D
Tempo médio
1 min
Resolução
Assine a AIO para ter acesso a esta e muitas outras resoluções
Mais de 300.000 questões com resoluções e dados exclusivos disponíveis para alunos AIO.
E mais: nota TRI a todo o momento.
E mais: nota TRI a todo o momento.
Saiba mais
Esta resolução não é pública. Assine a aio para ter acesso a essa resolução e muito mais:
Tenha acesso a simulados reduzidos, mais de 200.000 questões, orientação personalizada,
video aulas, correção de redações e uma equipe sempre disposta a te ajudar.
Tudo isso com acompanhamento TRI em tempo real.
Dicas
expand_more
expand_less
Dicas sobre como resolver essa questão
Erros Comuns
expand_more
expand_less
Alguns erros comuns que estudantes podem cometer ao resolver esta questão
Conceitos chave
Conceitos chave sobre essa questão, que pode te ajudar a resolver questões similares
Estratégia de resolução
Uma estratégia sobre a forma apropriada de se chegar a resposta correta
20%
Taxa de acerto
18.7
Média de pontos TRI
Habilidade
Avaliar propostas de intervenção no meio ambiente aplicando conhecimentos químicos, observando riscos ou benefícios.
Porcentagem de alternativa escolhida por nota TRI
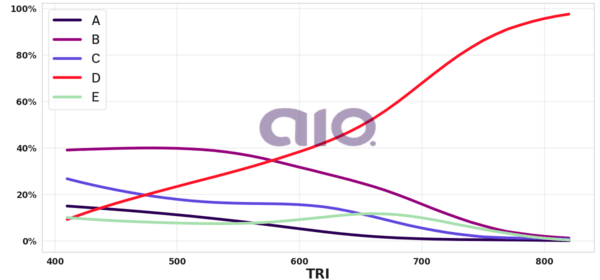
Porcentagem de alternativa escolhida por nota TRI

Transforme seus estudos com a AIO!
Estudantes como você estão acelerando suas aprovações usando nossa plataforma de
AI + aprendizado ativo.
+25 pts
Aumento médio TRI
4x
Simulados mais rápidos
+50 mil
Estudantes

Murilo Martins
Com a ajuda da AIO, aumentei os meus acertos nos simulados e no ENEM, além de garantia uma TRI mais elevada. Recomendo a AIO para estudantes de todo nível, sendo uma maneira de alavancar a sua nota no menor tempo possível!

Débora Adelina
O que mais gostei foi a forma como a plataforma seleciona matérias em que tenho mais dificuldade, ajudando a focar no que realmente preciso de atenção. Ainda não consegui minha aprovação, mas contarei com a AIO por mais um ano pois a plataforma me aproximou desse objetivo tornando meus estudos mais direcionados!

Jefferson, formando em Medicina
Com a plataforma AIO consegui acertar as 45 questões de ciências humanas no ENEM 2022! Sem dúvidas, obter a nota máxima nessa área, foi imprescindível para ser aprovado em medicina.


