IFPE Superior 2013
O ácido pirúvico é uma substância que se forma no corpo a partir do metabolismo dos carboidratos. A sua provável fórmula estrutural é:
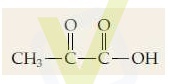
Nos músculos, o ácido pirúvico se reduz a ácido lático, principalmente durante a prática de exercícios físicos. O excesso de ácido lático nos músculos é responsável pela fadiga muscular, pela “dor na volta aos exercícios”. A equação química balanceada e simplificada que representa a formação do ácido lático encontra-se a seguir:

Em correlação ao que foi exposto, analise os itens a seguir.
I. O ácido pirúvico deve apresentar maior constante de acidez do que o ácido etanoico, visto que a carbonila atua como grupo retirador de elétrons.
II. O ácido pirúvico apresenta 1 carbono hibridizado em sp3 e dois carbonos hibridizados em sp2.
III. O ácido lático, pelas recomendações da IUPAC, deve ser nomeado ácido 2-hidróxi-propanoico.
IV. A estrutura do ácido lático admite dois comportamentos ópticos ativos, dextrógiro e levógiro, além de um comportamento óptico inativo, a mistura racêmica.
V. Sendo a constante de ionização do ácido pirúvico 3,6 x 10-3, o pH de uma solução 1,0 mol/L do ácido pirúvico será de 1,23. Dados: log 2 = 0,3 e log 3 = 0,47
Está correto o que se afirma nos itens
III e V, apenas.
II, III, IV e V, apenas.
I, II, III e IV, apenas.
I, III, IV e V, apenas.
I, II, III, IV e V.
E mais: nota TRI a todo o momento.





