clear
FAMEVAÇO Tipo A 2013/2
O ácido fórmico (HCOOH) decompõe-se na fase gasosa a temperaturas elevadas como a seguir:
HCOOH(g) → CO2(g) + H2(g)
A reação de decomposição é determinada como sendo de primeira ordem. Um gráfico da pressão parcial de HCOOH versus tempo para decomposição a uma determinada temperatura é mostrado na curva pontilhada. Quando uma pequena quantidade de ZnO sólido é adicionada à câmara de reação, a pressão parcial do ácido versus tempo varia como mostrado pela curva em linha contínua.
HCOOH(g) → CO2(g) + H2(g)
A reação de decomposição é determinada como sendo de primeira ordem. Um gráfico da pressão parcial de HCOOH versus tempo para decomposição a uma determinada temperatura é mostrado na curva pontilhada. Quando uma pequena quantidade de ZnO sólido é adicionada à câmara de reação, a pressão parcial do ácido versus tempo varia como mostrado pela curva em linha contínua.
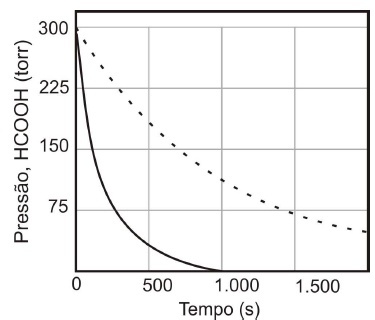
Analise as seguintes afirmativas concernentes ao processo de decomposição do ácido fórmico citado acima.
I. A reação prossegue mais rapidamente na presença de ZnO sólido. Assim a superfície do óxido atua como um catalisador.
II. Quando a reação se completa, consequentemente, a pressão será duas vezes a pressão inicial.
III. A energia de ativação do sistema com o óxido de zinco será mais elevada do que o sistema sem o ZnO.
A partir dessa análise, conclui-se que estão CORRETAS
I. A reação prossegue mais rapidamente na presença de ZnO sólido. Assim a superfície do óxido atua como um catalisador.
II. Quando a reação se completa, consequentemente, a pressão será duas vezes a pressão inicial.
III. A energia de ativação do sistema com o óxido de zinco será mais elevada do que o sistema sem o ZnO.
A partir dessa análise, conclui-se que estão CORRETAS
a
I e II, apenas.
b
I e III, apenas.
c
II e III, apenas.
d
I, apenas.
Ver resposta
Ver resposta
Resposta
A
Resolução
Assine a AIO para ter acesso a esta e muitas outras resoluções
Mais de 300.000 questões com resoluções e dados exclusivos disponíveis para alunos AIO.
E mais: nota TRI a todo o momento.
E mais: nota TRI a todo o momento.
Saiba mais
Esta resolução não é pública. Assine a aio para ter acesso a essa resolução e muito mais:
Tenha acesso a simulados reduzidos, mais de 200.000 questões, orientação personalizada,
video aulas, correção de redações e uma equipe sempre disposta a te ajudar.
Tudo isso com acompanhamento TRI em tempo real.
Dicas
expand_more
expand_less
Dicas sobre como resolver essa questão
Erros Comuns
expand_more
expand_less
Alguns erros comuns que estudantes podem cometer ao resolver esta questão
Conceitos chave
Conceitos chave sobre essa questão, que pode te ajudar a resolver questões similares
Estratégia de resolução
Uma estratégia sobre a forma apropriada de se chegar a resposta correta
Transforme seus estudos com a AIO!
Estudantes como você estão acelerando suas aprovações usando nossa plataforma de
AI + aprendizado ativo.
+25 pts
Aumento médio TRI
4x
Simulados mais rápidos
+50 mil
Estudantes

Jairo Thiago
Conheci a plataforma através de uma reportagem e, como gosto de IA, resolvi investir. A quantidade de questões e suas análises foram tão boas que meu número de acertos foi o suficiente para entrar em Medicina na Federal do meu estado, só tenho que agradecer à equipe do AIO pela minha tão sonhada aprovação!

Sarah
Neste ano da minha aprovação, a AIO foi a forma perfeita de eu entender meus pontos fortes e fracos, melhorar minha estratégia de prova e, alcançar uma nota excepcional que me permitiu realizar meu objetivo na universidade dos meus sonhos. Só tenho a agradecer à AIO ... pois com certeza não conseguiria sozinha.

Rejandson, vestibulando
Eu encontrei a melhor plataforma de estudos para o Enem do Brasil. A AIO é uma plataforma inovadora. Além de estudar com questões ela te dá a TRI assim que você termina.


