UnB 2010/1
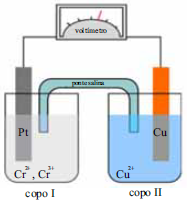
Nas células galvânicas, comumente denominadas pilhas, ocorrem reações de oxidação de redução arranjadas de forma que haja a transferência de elétrons através de um circuito externo e, assim, seja gerada corrente elétrica. A pilha representada na figura acima consiste de um eletrodo de platina mergulhado no copo I, que contém íons Cr3+ e Cr2+ em solução, e de outro eletrodo, de cobre, mergulhado no copo II, que contém uma solução de sulfato de cobre. Os potenciais padrões de redução, a 25 ºC, dos eletrodos envolvidos são apresentados abaixo.
Cr3+(g) + e- ⇔ Cr2+(g) E0 = – 0,41 V
Cu2+(g) + 2e- ⇔ Cu(g) E0 = + 0,34 V
Considerando essas informações e a de que a célula galvânica ilustrada está à temperatura de 25 ºC, julgue o item.
O valor negativo do potencial padrão de redução da meia-reação Cr3+ + e- ↔ Cr2+ indica que, em qualquer célula eletroquímica de que o sistema Cr3+/Cr2+ faça parte, o Cr2+ será oxidado a Cr3+.
CERTO
ERRADO
E mais: nota TRI a todo o momento.





