INSPER Ciências da Natureza 2019/2
Leia o texto para responder à questão.
A salmoura, um dos subprodutos da dessalinização da água, pode ser utilizada, por meio da eletrólise, para a produção dos gases hidrogênio e cloro. Nesse processo, uma cuba eletrolítica recebe uma solução saturada de cloreto de sódio que é submetida a uma tensão externa.
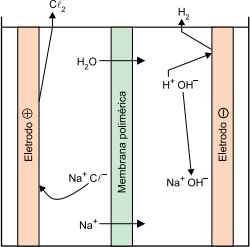
A reação global dessa eletrólise é representada pela equação:
2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + H2 (g) + Cl2 (g)
Nesse processo, a soda cáustica é um subproduto e o gás hidrogênio é um vetor energético, pois pode ser posteriormente empregado para geração de energia elétrica.
Na eletrólise da salmoura, o produto formado no ânodo e a quantidade de elétrons envolvidos na formação de 1 mol de gás cloro são, respectivamente,
H2 e 2.
H2 e 4.
H2 e 1.
Cl2 e 4.
Cl2 e 2
E mais: nota TRI a todo o momento.





