FBD 2017/2
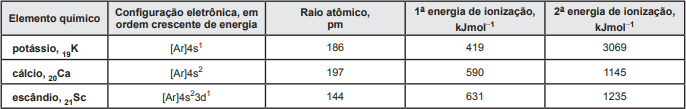
Íons de potássio e de cálcio, utilizados como nutrientes, e íons escândio, usados para a germinação de sementes, são originários de átomos de elementos químicos constituintes de um mesmo período da Tabela Periódica. Apesar de apresentarem o mesmo número de níveis eletrônicos, esses elementos químicos possuem quantidades de elétrons, valores de raios atômicos e energias de ionização diferentes, conforme dados apresentados na tabela.
Considerando-se essas informações, é correto afirmar:
O primeiro elétron do átomo de escândio que deve ser removido para a formação do íon positivo é o do nível 3d.
A atração entre os prótons e os elétrons no átomo de cálcio é maior do que entre essas partículas no átomo de potássio.
A energia necessária para a retirada do terceiro elétron do nível de valência do átomo do escândio é menor do que 1235kJmol‒1.
A energia absorvida na formação do cátion bivalente do cálcio é maior do que a necessária para a formação do íon potássio com carga +2.
O cátion Ca2+, presente no cloreto de cálcio, CaCl2 (s), apresenta configuração eletrônica igual à do cátion Sc3+, no fluoreto de escândio, ScF3 (s).





