UNESP 2010/1
Instrução: Leia o texto a seguir, que servirá de base para respostas à questão.
O carbonato de cálcio pode ser encontrado na natureza na forma de rocha sedimentar (calcário) ou como rocha metamórfica (mármore). Ambos encontram importantes aplicações industriais e comerciais. Por exemplo, o mármore é bastante utilizado na construção civil tanto para fins estruturais como ornamentais. Já o calcário é usado como matéria-prima em diversos processos químicos, dentre eles, a produção da cal.
Considerando o papel do mármore na construção civil, é de suma importância conhecer a resistência desse material frente a desgastes provenientes de ataques de ácidos de uso doméstico. Em estudos de reatividade química foram realizados testes sobre a dissolução do mármore (carbonato de cálcio) utilizando ácidos acético e clorídrico. As concentrações e os volumes utilizados dos ácidos em todos os experimentos foram iguais a 6 M e 15 mL, respectivamente, assim como a massa de mármore foi sempre igual a 1 g, variando-se a temperatura de reação e o estado de agregação do mármore, conforme a tabela a seguir:
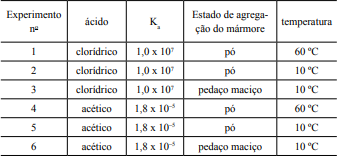
Com relação aos experimentos, pode-se afirmar que
os experimentos 5 e 6 apresentam a mesma velocidade de dissolução do mármore porque a superfície de contato de um sólido não afeta a velocidade de uma reação química.
o experimento 1 ocorre mais lentamente que o 2, porque quanto maior for a temperatura, menor será a velocidade de uma reação química.
o experimento 1 ocorre mais rapidamente que o 4, porque a concentração de íons H+ em 1 é maior que no experimento 4.
o experimento 4 ocorre mais lentamente que o 5, porque quanto maior for a temperatura, menor será a probabilidade de ocorrer colisões efetivas entre os íons dos reagentes.
o experimento 3 ocorre mais lentamente que o 6, porque quanto maior for a concentração dos reagentes, maior será a velocidade de uma reação química.
E mais: nota TRI a todo o momento.





