ENEM 2021 segunda aplicação
Grande parte da atual frota brasileira de veículos de passeio tem tecnologia capaz de identificar e processar tanto o etanol quanto a gasolina. Quando queimados, no interior do motor, esses combustíveis são transformados em produtos gasosos, num processo com variação de entalpia menor que Zero (ΔH < 0).Esse processo necessita de uma energia de ativação, a qual é fornecida por uma centelha elétrica.
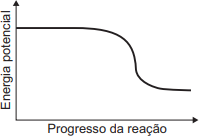
O gráfico que esboça a variação da energia potencial no progresso da reação é representado por:
Resolução
Passo a passo da solução:
- Identificar as informações chave no texto: O texto descreve a combustão de etanol e gasolina em motores. As informações cruciais são:
- A variação de entalpia é menor que zero (ΔH < 0). Isso significa que a reação é exotérmica, ou seja, libera energia. Em um gráfico de energia potencial, isso implica que a energia dos produtos (estado final) é menor que a energia dos reagentes (estado inicial).
- O processo necessita de uma energia de ativação, fornecida por uma centelha elétrica. Isso significa que, para a reação começar, é preciso fornecer energia para atingir um estado de transição (complexo ativado), que tem energia maior que a dos reagentes. No gráfico, isso é representado por uma "barreira" ou "pico" de energia que deve ser superado.
- Analisar os gráficos fornecidos: Cada gráfico representa a variação da energia potencial ao longo do progresso da reação. Precisamos encontrar o gráfico que satisfaça as duas condições identificadas no passo 1.
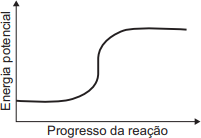
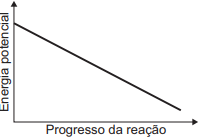
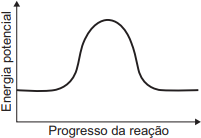
- Condição 1 (ΔH < 0 - Exotérmica): O nível de energia final (produtos) deve ser mais baixo que o nível de energia inicial (reagentes). Isso elimina os gráficos A e C, onde o nível final é maior ou igual ao inicial, respectivamente.
- Condição 2 (Energia de Ativação): Deve haver uma barreira de energia (pico) entre os reagentes e os produtos. Isso elimina os gráficos B e D, que mostram uma transição direta (linear ou curva) sem um pico intermediário de energia.
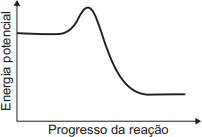
- Selecionar o gráfico correto: O único gráfico que atende às duas condições é o gráfico E.
- Ele mostra que a energia inicial (reagentes) é maior que a energia final (produtos), caracterizando uma reação exotérmica (ΔH < 0).
- Ele também mostra um pico de energia entre os reagentes e os produtos, representando a energia de ativação necessária para a reação ocorrer.
Portanto, o gráfico que representa corretamente a variação da energia potencial na combustão descrita é o da alternativa E.
Dicas
Erros Comuns
Revisão de Conceitos:
- Energia Potencial em Reações Químicas: Representa a energia armazenada nas ligações químicas das substâncias. Durante uma reação, ligações são quebradas (consome energia) e novas ligações são formadas (libera energia).
- Gráfico de Energia Potencial vs. Progresso da Reação: Mostra como a energia potencial do sistema muda à medida que os reagentes se transformam em produtos. O eixo Y representa a energia potencial e o eixo X representa o "caminho" da reação.
- Energia de Ativação (Ea): É a energia mínima necessária para que os reagentes iniciem a transformação em produtos. Corresponde à diferença de energia entre os reagentes e o estado de transição (o ponto mais alto do gráfico).
- Variação de Entalpia (ΔH): É a diferença entre a entalpia (energia) dos produtos e a entalpia dos reagentes (\( \Delta H = H_{produtos} - H_{reagentes} \)).
- Reação Exotérmica: Libera calor para o ambiente (ΔH < 0). Os produtos têm menos energia que os reagentes. O gráfico termina em um nível de energia mais baixo que o inicial.
- Reação Endotérmica: Absorve calor do ambiente (ΔH > 0). Os produtos têm mais energia que os reagentes. O gráfico termina em um nível de energia mais alto que o inicial.
- Combustão: É uma reação química exotérmica que geralmente envolve um combustível e um oxidante (como o oxigênio), liberando calor e luz. Por ser exotérmica, sempre terá ΔH < 0.
Utilizar leis físicas e (ou) químicas para interpretar processos naturais ou tecnológicos inseridos no contexto da termodinâmica e(ou) do eletromagnetismo.