UESB Caderno 3 2014
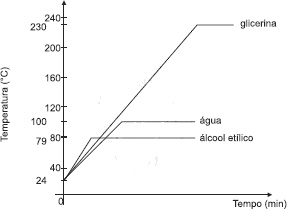
Experiências realizadas com água, H2O(l), álcool etílico e glicerina, representados, respectivamente, pelas fórmulas condensadas H3CCH2OH(l) e H2C(OH)CH(OH)CH2OH(l), mostram que, durante a passagem do estado líquido para o gasoso, a temperatura permanece constante, de acordo com as curvas de aquecimento representadas no gráfico.
Considerando-se a análise dessas informações e os modelos de ligações químicas, é correto afirmar:
À temperatura de 79ºC, toda a massa de álcool etílico usada no experimento se encontra na fase gasosa.
À temperatura de 230ºC, existe um equilíbrio dinâmico entre os estados físicos líquido e gasoso, na glicerina.
A temperatura de ebulição está associada ao tipo de ligação interatômica existente na estrutura química das substâncias.
A água apresenta ligações de hidrogênio de maior intensidade do que as interações dipolo instantâneo-dipolo induzido das outras substâncias analisadas.
A diferença nos valores das temperaturas de ebulição das substâncias está relacionada com os diferentes tipos de interações intermoleculares existentes entre suas moléculas.
E mais: nota TRI a todo o momento.





