UFMS 2022
Em um vaso reacional fechado, foram colocados 0,300mol/L de gás nitrogênio e 0,200mol/L de água, mantendo-se a temperatura em 55ºC e uma pressão de 123atm. Após um curto período de tempo, constatou-se que a reação atingiu o equilíbrio, com formação de 0,060mol/L do sal nitrito de amônio (NH4NO2), conforme demonstrado abaixo. Com o intuito de tornar a reação produto favorecida, foram feitas três intervenções, separadamente, seguidas de análise. Na primeira intervenção, adicionou-se catalisador de ródio (Rh) à reação. Na segunda, diminuiu-se a pressão do sistema e, na última intervenção, adicionou-se mais 0,100mol/L de NH4NO2.
Assinale a alternativa correta em relação às três intervenções feitas na reação, de acordo com os Princípios de Le Chatelier.
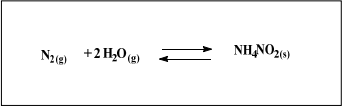
A adição do catalisador tornará a reação produto favorecida.
Nenhuma das intervenções tornará a reação produto favorecida.
A diminuição da pressão deslocará o equilíbrio em direção ao produto.
Com a adição do sal NH4NO2, mais produto será formado.
Somente a diminuição da pressão e a adição de catalisador são capazes de deslocar a reação em direção ao produto.
E mais: nota TRI a todo o momento.





