FUVEST 2021
Em aquários de água marinha, é comum o uso do equipamento chamado “Skimmer', aparato em que a água recebe uma torrente de bolhas de ar, como representado na figura, levando a matéria orgânica até a superfície, onde pode ser removida. Essa matéria orgânica eliminada é composta por moléculas orgânicas com parte apolar e parte polar, enquanto as bolhas formadas têm caráter apolar. Esse aparelho, no entanto, tem rendimento muito menor em aquários de água doce (retira menos quantidade de material orgânico por período de uso).
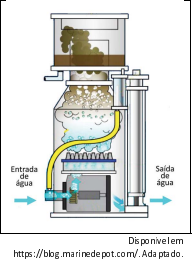
Considerando que todas as outras condições são mantidas, o menor rendimento desse aparato em água doce do que em água salgada pode ser explicado porque
a polaridade da molécula de água na água doce é maior do que na água salgada, tornando as partes apolares das moléculas orgânicas mais solúveis.
a menor concentração de sais na água doce torna as regiões apolares das moléculas orgânicas mais solúveis do que na água salgada, prejudicando a interação com as bolhas de ar.
a água doce é mais polar do que água salgada por ser mais concentrada em moléculas polares como a do açúcar, levando as partes polares das moléculas orgânicas a interagir mais com a água doce.
a reatividade de matéria orgânica em água salgada é maior do que em água doce, fazendo com que exista uma menor quantidade de material dissolvido para interação com as bolhas de ar.
a concentração de sais na água marinha é maior, o que torna as partes apolares das moléculas orgânicas mais propensas a interagir com os sais dissolvidos, promovendo menor interação com as bolhas de ar.
E mais: nota TRI a todo o momento.





