ENEM 2019
Em 1808, Dalton publicou o seu famoso livro o intitulado Um novo sistema de filosofia química (do original A New System of Chemical Philosophy), no qual continha os cinco postulados que serviam como alicerce da primeira teoria atômica da matéria fundamentada no método científico. Esses postulados são numerados a seguir:
1. A matéria é constituída de átomos indivisíveis.
2. Todos os átomos de um dado elemento químico são idênticos em massa e em todas as outras propriedades.
3. Diferentes elementos químicos têm diferentes tipos de átomos; em particular, seus átomos têm diferentes massas.
4. Os átomos são indestrutíveis e nas reações químicas mantêm suas identidades.
5. Átomos de elementos combinam com átomos de outros elementos em proporções de números inteiros pequenos para formar compostos.
Após o modelo de Dalton, outros modelos baseados em outros dados experimentais evidenciaram, entre outras coisas, a natureza elétrica da matéria, a composição e organização do átomo e a quantização da energia no modelo atômico.
OXTOBY, DW.; GILLIS, H. PR; BUTLER, L.J. Principles of Modem Chemistry. Boston: Cengage Learning, 2012 (adaptado).
Com base no modelo atual que descreve o átomo, qual dos postulados de Dalton ainda é considerado correto?
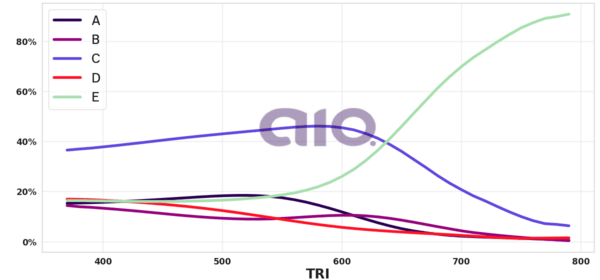
E mais: nota TRI a todo o momento.
Relacionar informações apresentadas em diferentes formas de linguagem e representação usadas nas ciências físicas, químicas ou biológicas, como texto discursivo, gráficos, tabelas, relações matemáticas ou linguagem simbólica.