OBQ 2015
As reações de oxidação são muito comuns no cotidiano. Por exemplo:
I. Quando usamos o permanganato de potássio, um sal violeta que podemos adquirir na farmácia, e o diluímos em água para lavar feridas da catapora ou frieiras nos pés, estamos fazendo reação de oxidação branda. Na Química esta solução é chamada de Reativo de Baeyer.
II. Nos bafômetros é usado dicromato de potássio (alaranjado) dissolvido em água e ácido sulfúrico. Esta solução, chamada “solução sulfocrômica”, oxida o etanol a ácido etanoico, mudando a coloração variando de alaranjado para verde ou azul, de acordo com a concentração de etanol contida no ar expirado.
III. Na purificação de ambientes, materiais hospitalares e até no tratamento da água é usado o ozônio. A reação é chamada ozonólise, seguida de hidratação, na presença de zinco.
O esquema a seguir mostra as reações quando o ciclo-hexeno é submetido às respectivas oxidações.
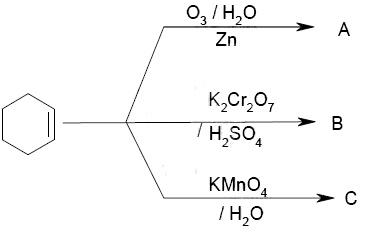
Os produtos A, B e C são, respectivamente:
hexanodial, ácido hexanodioico, ciclo-hexano-1,2-diol
ciclo-hexano, ciclo-hexanol, ácido hexanoico
ciclo-hexano-1,2-diol, ácido hexanoico, hexanal
hexanodial, ciclo-hexanol, ácido hexanoico
ácido hexanodioico, hexanal, ciclo-hexanol
E mais: nota TRI a todo o momento.





