clear
UEFS 2013/2
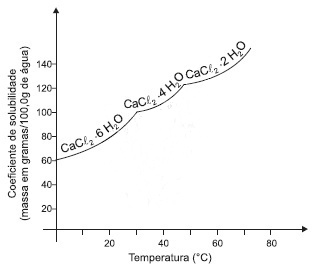
As curvas de solubilidade são gráficos que representam a variação dos coeficientes de solubilidade de substâncias em função de temperatura. Esses gráficos têm grande importância no estudo das soluções de sólidos em líquidos, em razão de a temperatura ser o único fator físico perceptivo, na solubilidade. O gráfico mostra a variação de solubilidade do cloreto de cálcio hexaidratado, CaCl2 · 6H2O, em função da temperatura.
Tendo em vista essas considerações, é correto afirmar:
Tendo em vista essas considerações, é correto afirmar:
a
A dissolução em água do CaCl2 · 6H2O ocorre com liberação de calor.
b
A 0oC, a solução contém, no máximo, 0,20mol de CaCl2 · 6H2O dissolvidos em 100,0g de água.
c
O reticulo cristalino do CaCl2 · 6H2O se mantém intacto durante o processo de aquecimento até 70oC.
d
O coeficiente de solubilidade do CaCl2 · 6H2O, em água, permanece o mesmo até a primeira inflexão da curva.
e
O resfriamento de uma solução de CaCl2 · 4H2O, de 40oC até 20oC, ocorre com modificações na estrutura do soluto.
Ver resposta
Ver resposta
Resposta
E
Tempo médio
1 min
Resolução
Assine a AIO para ter acesso a esta e muitas outras resoluções
Mais de 300.000 questões com resoluções e dados exclusivos disponíveis para alunos AIO.
E mais: nota TRI a todo o momento.
E mais: nota TRI a todo o momento.
Saiba mais
Esta resolução não é pública. Assine a aio para ter acesso a essa resolução e muito mais:
Tenha acesso a simulados reduzidos, mais de 200.000 questões, orientação personalizada,
video aulas, correção de redações e uma equipe sempre disposta a te ajudar.
Tudo isso com acompanhamento TRI em tempo real.
Dicas
expand_more
expand_less
Dicas sobre como resolver essa questão
Erros Comuns
expand_more
expand_less
Alguns erros comuns que estudantes podem cometer ao resolver esta questão
Conceitos chave
Conceitos chave sobre essa questão, que pode te ajudar a resolver questões similares
Estratégia de resolução
Uma estratégia sobre a forma apropriada de se chegar a resposta correta
Transforme seus estudos com a AIO!
Estudantes como você estão acelerando suas aprovações usando nossa plataforma de
AI + aprendizado ativo.
+25 pts
Aumento médio TRI
4x
Simulados mais rápidos
+50 mil
Estudantes

Rejandson, vestibulando
Eu encontrei a melhor plataforma de estudos para o Enem do Brasil. A AIO é uma plataforma inovadora. Além de estudar com questões ela te dá a TRI assim que você termina.

Débora Adelina
O que mais gostei foi a forma como a plataforma seleciona matérias em que tenho mais dificuldade, ajudando a focar no que realmente preciso de atenção. Ainda não consegui minha aprovação, mas contarei com a AIO por mais um ano pois a plataforma me aproximou desse objetivo tornando meus estudos mais direcionados!

Mariana Scheffel
AIO foi fundamental para a evolução do meu número de acertos e notas, tanto no ENEM quanto em outros vestibulares, fornecendo os recursos e as ferramentas necessárias para estudar de forma eficaz e melhorar minhas notas.


