UFGD 2020
Ácidos e bases são substâncias presentes em inúmeros processos químicos que ocorrem ao nosso redor, desde processos industriais até processos biológicos e reações que ocorrem no ambiente. A força relativa desses ácidos ou bases podem ser expressas quantitativamente a partir de sua constante de equilíbrio ácida ou básica. Analise a tabela a seguir com alguns ácidos e bases ordenados em função de sua capacidade de doar ou receber prótons e seus respectivos valores de Ka e Kb.
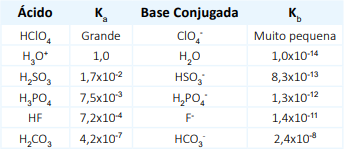
Com base na análise da tabela e nas propriedades dos ácidos e bases, assinale a alternativa correta.
Segundo a teoria de Bronsted-Lowry, as bases conjugadas de ácidos fracos possuem ligeira habilidade em remover prótons da água.
Ácidos fortes transferem parcialmente seus prótons para a água, resultando em uma mistura de moléculas de ácidos e seus íons constituintes em solução.
As bases conjugadas de ácidos fortes produzem soluções mais básicas que as bases conjugadas de ácidos fracos.
O ácido perclórico é considerado um ácido fraco, uma vez que sua base conjugada possui um valor de Kb “muito pequena”.
Todo ácido e base de Lewis é também um ácido e base de Bronsted-Lowry.
E mais: nota TRI a todo o momento.





