UEL 2017
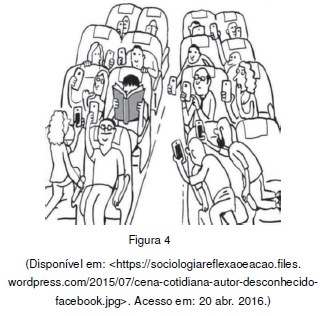
A tabela periódica classifica os elementos químicos em períodos (faixas horizontais) e grupos (faixas verticais). Essa classificação mostra que elementos químicos podem apresentar propriedades físicas e químicas similares ou completamente diferentes em função de sua localização na tabela periódica. Uma observação mais detalhada da charge, se inclinada a 90◦ à direita, permite remeter a uma tabela periódica, pois indivíduos que fazem uso de celular apresentam comportamentos diferentes em relação ao indivíduo que está lendo o livro.
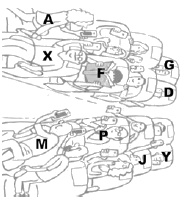
De acordo com a imagem, foram atribuídas algumas letras escolhidas arbitrariamente, mas que não correspondem aos símbolos dos elementos químicos na tabela periódica.
Sobre os conhecimentos acerca da classificação e propriedade periódica dos elementos e em consonância com a imagem, assinale a alternativa correta.
Se os indivíduos designados pelas letras A e X representam, respectivamente, Ca (Z = 20) e Sr (Z = 38), então o número de elétrons na camada de valência é diferente para os dois elementos químicos.
Se o indivíduo designado pela letra F, que está lendo o livro, também faz uso de celular, então este elemento comportase como um gás nobre.
Se os indivíduos designados pelas letras G e D representam, respectivamente, Cℓ (Z = 17) e Br (Z = 35), então D é maior e possui menor eletronegatividade que G.
Se os indivíduos designados pelas letras M e P representam, respectivamente, Cr (Z = 24) e Mn (Z = 25), então o número de elétrons na camada de valência é o mesmo para os dois elementos químicos.
Se os indivíduos designados pelas letras J e Y representam, respectivamente, Sn (Z = 50) e Sb (Z = 51), então J é menor e possui menor eletropositividade que Y.
E mais: nota TRI a todo o momento.





