UPF Verão 2021
A questão devem ser respondidas com base nas informações a seguir.
Em geral, metais, grande parte dos cerâmicos e certos polímeros cristalizam-se quando se solidificam. Os átomos se arranjam em uma estrutura tridimensional ordenada e repetida. Estas estruturas são chamadas cristais.
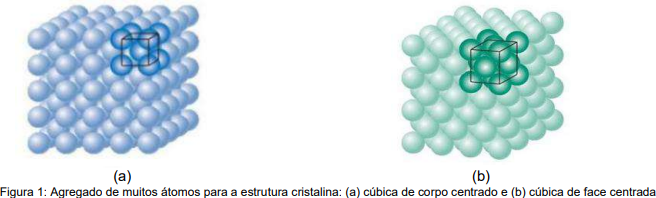
A célula unitária é o menor volume repetido no interior de um cristal. É a unidade básica repetitiva da estrutura tridimensional do cristal e é escolhida para representar a simetria da estrutura cristalina. Duas das geometrias básicas das células unitárias são a cúbica de corpo centrado (Figura a) e a cúbica de face centrada (Figura b), ilustradas esquematicamente a seguir.
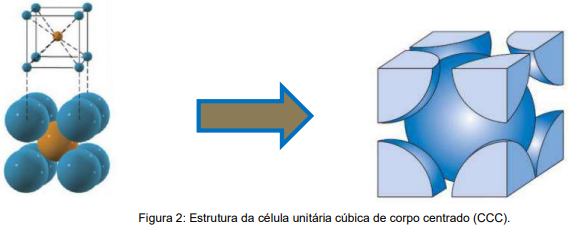
A rede cúbica de corpo centrado (CCC) é uma rede cúbica na qual existe um átomo em cada vértice, que na célula unitária é representado por 1/8 de átomo, e um átomo no centro do cubo. Os átomos se tocam ao longo da diagonal.
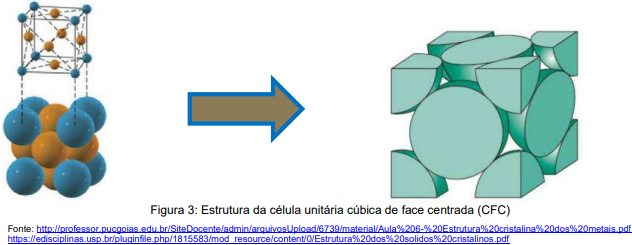
A rede cúbica de face centrada (CFC) é uma rede cúbica na qual existe um átomo em cada vértice e um átomo no centro de cada face do cubo, na célula unitária compondo 1\8 e 1\2 átomo, respectivamente. Os átomos se tocam ao longo das diagonais das faces do cubo.
Para calcular o fator de empacotamento atômico em cada rede, é necessário utilizar o volume do átomo representado pelas esferas.
A quantidade de átomos em cada célula unitária, da rede cúbica de corpo centrado (CCC) e da rede cúbica de face centrada (CFC), respectivamente é:
3 e 6
2 e 6
2 e 4
3 e 4
2 e 5





