UNIFOR 2020
A pilha seca ácida foi desenvolvida em 1866, pelo químico francês George Leclanché (1839-1882). Ela é a pilha mais comum hoje em dia, pois é a mais barata e a mais usada em lanternas, rádios, equipamentos portáteis e aparelhos elétricos, entre outros.
Disponível em https://mundoeducacao.bol.uol.com.br/quimica/pilha-seca-leclanche.htm. Acesso em 09 Out 2019. Adaptado
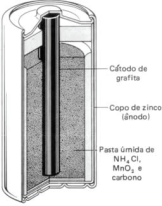
Dados:
Zn2+(aq) + 2 e- → Zn(s) E= - 0,76V
2 MnO2(aq) + 2 NH41+(aq) → Mn2O3(s) + 2NH3(g) + H2O(l) E= 0,74V
Sobre a pilha de LeClanché, podemos afirmar que
essa pilha na verdade é seca, pois dentro dela não existe umidade.
a reação em seu cátodo é: Zn(s) → Zn2+(aq) + 2 e-
a equação balanceada da reação no anodo é: 2 MnO2(aq) + 2 NH41+(aq) + 2e- → Mn2O3(s) + 2NH3(g) + H2O(l).
a equação global de funcionamento desta pilha será: Zn(s) + 2 MnO2(aq) + 2 NH41+(aq) → Zn2+(aq) + 1 Mn2O3(s) + 2NH3(g).
seu funcionamento cessa definitivamente quando todo o zinco metálico se acumula.
E mais: nota TRI a todo o momento.





