Unit-AL 2018
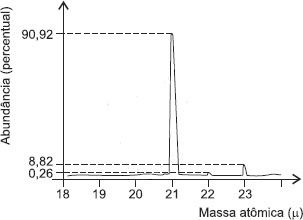
A maioria dos elementos químicos é constituída por uma mistura de dois ou mais isótopos. A massa de cada isótopo é a abundância percentual na composição do elemento químico e podem ser determinadas por meio de espectro atômico, se utilizando um espectômetro de massa. O gráfico representa a abundância percentual, em função da massa atômica dos isótopos do elemento químico neônio, determinado por um espectômetro de massa.
A análise desse espectro de massa do elemento químico neônio permite corretamente concluir:
A massa atômica do neônio é, aproximadamente, 20,179u.
A unidade de massa atômica, u, constitui 1/12 do átomo de carbono 14.
A massa atômica do isótopo 21 do neônio é desprezível no cálculo da massa atômica do neônio.
O espectômetro não oferece, experimentalmente, grande precisão na determinação de massas atômicas.
Os isótopos, embora possuam número de nêutrons iguais ao do elemento químico, reagem, diferentemente, do ponto de vista de Química.
E mais: nota TRI a todo o momento.





