UNICENTRO 2017
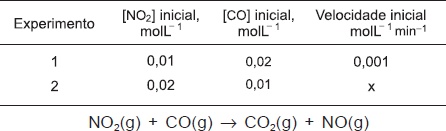
A Lei da velocidade de uma reação química é determinada, experimentalmente, porque, em geral, as reações ocorrem em duas ou mais etapas, e não diretamente como sugere a equação química. A reação química entre NO2(g) e CO(g) não é elementar, portanto ocorre em mais de uma etapa e tem Lei de velocidade representada pela expressão v = k[NO2]2, a 200oC.
Essas considerações e as informações da tabela permitem corretamente concluir
A velocidade da reação representada por x na tabela é igual a 4,0.10−3molL−1min−1.
O valor numérico da constante de velocidade, k, de reação é igual a 1,0mol−1Lmin−1.
A velocidade de reação se torna o dobro da inicial, ao se duplicar a concentração de NO2(g).
A etapa lenta da reação ocorre por meio da colisão entre uma molécula de NO2(g) e uma molécula de CO(g).
A molecularidade de uma reação química representa o número máximo de moléculas que colidem em cada reação elementar.
E mais: nota TRI a todo o momento.





