UNICENTRO 2020
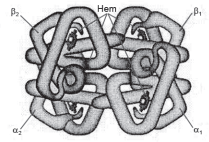
A hemoglobina é uma proteína de estrutura quaternária. Ela é composta por quatro cadeias de globina (parte proteica) e um grupo heme (grupo prostético) ligado a cada uma delas. Em adultos, as cadeias de globina são de dois tipos: duas do tipo α (alfa) e duas do tipo β (beta). O grupo heme contém um átomo de ferro central em seu interior, mantido no estado ferroso. O ferro é o responsável pela captação do oxigênio, uma vez que o mineral se liga ao oxigênio com facilidade. A globina não serve apenas para a função estrutural, mas também torna possível a reversibilidade da ligação entre o ferro e o oxigênio. (A HEMOGLOBLINA, 2019).
A análise dessas informações, da figura apresentada e dos conhecimentos sobre hemoglobina possibilitam afirmar:
Os metais de transição formam sempre ligações covalentes com outros elementos químicos.
A molécula de nitrogênio possui ligações π e σ entre átomos de nitrogênio.
As moléculas de oxigênio e de monóxido de carbono são ambas polares.
O Nox do ferro permanece igual a zero durante o processo de respiração. As proteínas complexas são sais derivados de aminoácidos.
As proteínas complexas são sais derivados de aminoácidos.
E mais: nota TRI a todo o momento.





