UnB 2012/2
A eletrólise de soluções aquosas de NaCl é de grande interesse industrial, pois permite a obtenção de três insumos importantes: cloro, hidrogênio e hidróxido de sódio. O primeiro é empregado principalmente na produção do PVC (policloreto de vinila); o segundo, na hidrogenação de óleos e gorduras; e o último, principalmente na indústria de papel. Considere que a reação a seguir seja a única que ocorre durante a eletrólise aquosa do NaCl.
2NaCl(aq) + 2H2O(l) ⇔ 2NaOH(aq) + H2(g) + Cl2(g)
Tomando 0,30 como valor aproximado de log102 e supondo que a constante de Faraday seja igual a 96.500 C/mol, que a constante de autoionização da água (Kw) seja igual a 1,0 × 10-14 e que as soluções apresentem comportamento ideal, julgue o item.
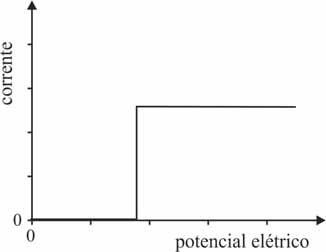
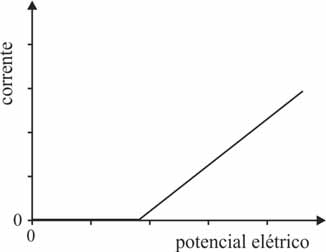
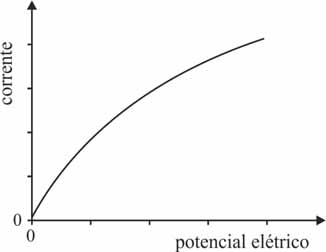
Considere que, ao ligar a fonte de eletricidade para colocar em funcionamento uma célula eletrolítica, o potencial elétrico seja aumentado, gradativamente, desde zero até o valor desejado. Nesse caso, que opção melhor representa o comportamento da corrente elétrica na célula em função do potencial elétrico aplicado?